共沸现象及其应用
(2023年湖北卷)实验室用以下装置(夹持和水浴加热装置略)制备乙酸异戊酯(沸点142℃),实验中利用环己烷-水的共沸体系(沸点69℃)带出水分。已知体系中沸点最低的有机物是环己烷(沸点81℃),其反应原理:
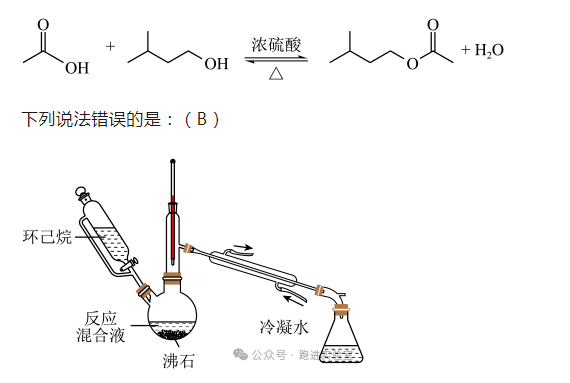
| A.以共沸体系带水促使反应正向进行 | B.反应时水浴温度需严格控制在69℃ |
| C.接收瓶中会出现分层现象 | D.根据带出水的体积可估算反应进度 |
解析:
A.由反应方程式可知,生成物中含有水,若将水分离出去,可促进反应正向进行,该反应选择以共沸体系带水可以促使反应正向进行,A正确;
B.反应产品的沸点为142℃,环己烷的沸点是81℃,环己烷-水的共沸体系的沸点为69℃,可以温度可以控制在69℃~81℃之间,不需要严格控制在69℃,B错误;
C.接收瓶中接收的是环己烷-水的共沸体系,环己烷不溶于水,会出现分层现象,C正确;
D.根据投料量,可估计生成水的体积,所以可根据带出水的体积估算反应进度,D正确;
故选B。
共沸现象,作为题干中出现的信息直接呈现给考生,考察学生依据实验目的调控反应,分析“加入环己烷”这个措施后如何调整温度,落实科学探究与创新意识核心素养。
共沸现象是二组分液相混合物加热气化过程中出现的沸点恒定现象,这个沸点恒定现象不同于简单蒸馏过程中温度到达某一单一组分沸点后这一单一组分气化蒸出。这里是多个组分同时在某一温度被蒸出,混合物的组成也就是相对百分含量在气液两相中完全相同,得到的也是混合物,也就是说:在某一压力下,共沸混合物无法通过蒸馏或分馏分离。
共沸现象产生的原因是实际混合物行为偏离理想液态混合物的相变的行为,不遵循拉乌尔定律和亨利定律。具体原理请还需进一步研究物化相平衡理论。由于实际液态混合物与理想液态混合物的偏差导致共沸混合物产生了两个极端,即共沸物的沸点高于纯组分单一存在时的沸点和共沸物的沸点低于纯组分单一存在时的沸点。
湖北高考题采用环己烷与水形成共沸混合物,降低了水的沸点,利于水的快速蒸出,利于平衡持续不断右移,提高转化率和产率,这是有益于反应的。相似的操作在高考模拟题中也会见到:(苯的作用?除了做溶剂还与水形成共沸混合物利于水的快速蒸出。)
查阅资料显示:当苯的摩尔分数占91.1%,水的摩尔8.9%的苯水混合体系形成时,就组成共沸混合物,它的沸点只有69.4度,低于任一单一组分的沸点,当然此题中还涉及其他组分,恒沸点温度可能与资料温度有出入。
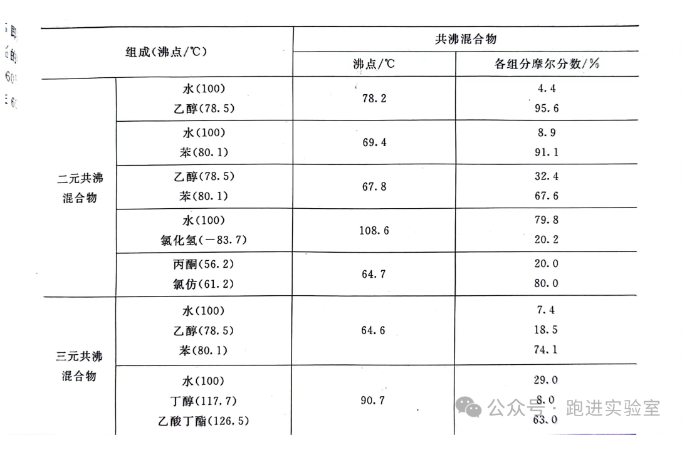
刚才讲了共沸混合物有利于实验的一面,当然形成共沸混合物也有麻烦的一面。比如有些条件苛刻的在乙醇中的合成反应需要严格的无水环境,就要用到绝对乙醇。乙醇与水之间存在强烈的分子间氢键作用,95%的乙醇溶液就是一个共沸混合物,从95乙醇制备无水乙醇或绝对乙醇时就要打破共沸体系,单纯常压下提高温度精馏无法实现分离,这时需要通过改变压力或使用其他手段。常需要加入生石灰吸水,在蒸馏得到99.5%的无水乙醇,如需要纯度更高的绝对乙醇,则还需用钠丝或镁丝处理,得到的绝对乙醇保存时还需非常注意防水除湿。
声 明:文章内容来源于跑进实验室 。如有侵权,请联系小编删除,谢谢!
